Latihan 3 & Quis 3
Latihan 3
Chapter 7
1. Bilangan kuantum azimuth (l) yang masih dimungkinkan untuk l = 4 adalah….
A. 1, 2, 3
B. 0, 1, 2, 3
C. 1, 2, 3, 4,
D. 0, 1, 2, 3, 4
E. Tidak bergantung pada harga n
Pembahasan :
Jika n = 4, maka :
Harga l = 0, …..(n-1) = 0, 1, 2, 3
3. Konfigurasi elektron unsur yang bernomor atom 23 adalah….
a. 1s22s22p63s23p64s24p3
b. 1s22s22p63s23p64s23d24p1
c. 1s22s23s23p64s5
d. 1s22s22p63s23p64s23d3
e. 1s22s22p63s23p63d5
a. [Ar] 3d9 4s2
b. [Ar] 3d10 4s1
c. [Kr] 4d9 5s1
d. [Ar] 4d9 5s2
e. [Kr] 4d10 5s1
Quis 3
1. Benda bermassa 100000 kg bila dituliskan dalam notasi ilmiah akan menjadi...
a. 10-3
b. 10-6
c. 104
d. 10-2
e. 105
Penjelasan:
Jawabannya ialah E. Dalam notasi ilmiah bilangan dinyatakan
sebagai a
× 10n dengan a = bilangan asli mulai dari 1 sampai dengan 9. Maka,
10000 dituliskan dalam bentuk 105
2. Kegiatan dengan menggunakan panca indra untuk mendapatkan informasi tentang sesuatu disebut ….
a. Observasi
b. Bertanya
c. Meramal
d. Mengumpulkan informasi
e. Mencari literatur
1. Nilai muatan elektron dapat ditentukan dengan percobaan tetes minyak yang dilakukan oleh ....
a. Bohr
b. Rutherford
c. Thomson
d. Robert Andrew Millikan
e. Dalton
2. Pernyataan yang benar mengenai X56 dan X57 adalah …. kecuali
a. Merupakan isotop
b. Merupakan unsur yang sama
c. Mempunyai jumlah elektron yang sama
d. Mempunyai jumlah neutron yang sama
e. Mempunyai sifat kimia yang sama
Pembahasan :
X56 dan X57 merupakan isotop yaitu atom yang sama mempunyai jumlah proton yang sama tetapi berbeda nomor massa dan neutronnya. Karena mempunyai jumlah elektron yang sama sehingga mempunyai sifat kimia yang sama. (Sifat kimia berkaitan dengan sifat reaksi).
Chapter 3
a. 1 : 16
b. 1 : 14
c. 1 : 12
d. 1 : 10
e. 1 : 8
2.Berapa gram massa Ca dari 6 mol
(Ar Ca = 40 ) ?
a. 260 gram
b. 250 gram
c. 240 gram
d. 230 gram
e. 220 gram
Caranya :
mol Ca=massa /Ar
massa Ca=6 mol×40 SMA
massa Ca=240 gram
Chapter 4
1.Suatu reaksi kimia yang berlangsung pada suhu 30°C memerlukan waktu 40 detik. Setiap kenaikan suhu 10°C, reaksi akan lebih cepat dua kali dari semula. berapakah waktu yang diperlukan jika suhu dinaikkan menjadi 50°C…
a. 30 detik
b. 20 detik
c. 15 detik
d. 10 detik
e. 5 detik
Caranya :
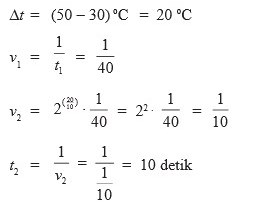
2. Kertas lakmus biru akan berubah menjadi merah, bila dimasukkan ke dalam larutan…
a. Kalium hidroksida
b. Natrium klorida
c. Barium sulfat
d. Asam klorida
e. Natrium nitrat
Chapter 5
1. Diketahui kota A terletak pada ketinggian 700 m di atas permukaan air laut. Tentukan tekanan udara di kota A
a. 99 mmHg
b. 69 mmHg
c. 69 cmHg
d. 6900 cmHg
e. 70 mmHg
Caranya :
tekanan udara
P = 76 - h/100
P = 76 - 700/100
P = 76 - 7
P = 69 cmHg
2. Gas ideal berada dalam ruang tertutup dengan volume V, tekanan P dan suhu T. Apabila volumenya mengalami perubahan menjadi 1/2 kali semula dan suhunya dinaikkan menjadi 4 kali semula, maka tekanan gas yang berada dalam sistem tersebut menjadi….
A. 8 P1
B. 2 P1
C. 1/2 P1
D. 1/4 P1
E. 1/8 P1
Caranya :
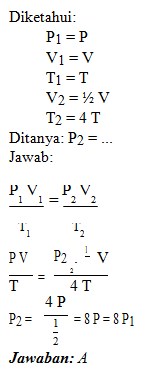
Chapter 6
1.Sepotong perak bermassa 362 g memiliki kapasitas panas 85,7 J /C. Berapa kalor jenis perak.....(J/gC)
2. Dalam calorimeter terdapat zat yang bereaksi secara eksotermik dan ternyata 0,5 kg air yang mengelilinginya sebagai pelarut mengalami kenaikan temperature sebesar 3° Kalor jenis air = 4,2 J/gram K. Kalor reaksi zat yang dilepaskan oleh reaksi itu adalah..
a. 577,6 kJ
b. 578,6 kJ
c. 579,6 kJ
d. 5796 kJ
e. 57,96 kJ
Caranya :
massa = 0,5 kg = 500 gram
T = 3°C + 273 = 276 K
Kalor jenis air = 4,2 J/gram K
q = m x c x ΔT
q = 500 x 4,2 x 276
q = 579.600 J
q = 579, 6 kJ
Chapter 8
1. Letak unsur dan konfigurasi elektron yang tepat untuk unsur 19X adalah…(nomor atom Ar = 18)
a. Periode 4, golongan IA, [Ar] 4s1
b. Periode 1, golongan IB, [Ar] 4d1
c. Periode 1, golongan IIA, [Ar] 4s2
d. Periode 2, golongan IIB, [Ar] 4d2
e. Periode 3, golongan IVA, [Ar] 4s2 3d2
Caranya :
menentukan letak unsur
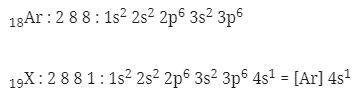
n = 4 → periode 4
eval = 1 → golongan IA
2. Di antara sifat berikut yang bukan merupakan sifat logam alkali adalah …
a. Terdapat di alam dalam keadaan bebas.
b. Persenyawaannya mudah larut dalam air.
c. Sangat lunak sehingga mudah diiris dengan pisau.
d. Unsur-unsur yang sangat reaktif.
e. Reduktor air yang sangat baik.
Chapter 9
a. Elektron valensi
b. Kecendrungan membentuk konfigurasi electron gas mulia
c. Lintasan electron
d. Neutron dalam inti atom
e. Proton dan neutron
2.Sebutkan sifat yang membedakan ikatan kovalen polar dan non polar
a.larut dalam pelarut
b.keelektronegatifan
c.titik didih
d.titik lebur
e.titik beku
Chapter 10
- dipol-dipol
- ion-ion
- ikatan hidrogen
- ion-dipol
- gaya dispersi.
2. Manakah molekul yang memiliki gaya tarik-menarik dipol-dipole antarmolekulnya? (Gunakan tabel periodik yang tersedia)
- AsH3
- BCl3
- Cl2
- CO2
- XeF4
a. Gaya antar molekul
b. Gaya tarik-menarik dipol-dipol
c. Gaya induksi
d. Gaya dispersi
e. Gaya London
2. Diantara senyawa berikut yang memiliki gaya London adalah ….
a. Br2
b. H2O
c. CHCl3
d. NH3
e. HCl
Chapter 12
2. Massa jenis H2SO4 pekat 49% m/m adalah 1,3 kg/L (mr H2SO4=98) Untuk memperoleh 260 ml H2SO4 0,05M diperlukan H2SO4 sebnyak ...... mL
a. 2
b. 4
c. 5
d. 6
e. 8
caranya :
V1 = 260 ml, dan M1 = 0,05 M, massa jenis = 1,3 kg/L atau 1,3 g/ml, % = 49%, Mr= 98
M2 = (% x massa jenis x 10)/Mr
=(49 x 1,3 x 10)/98
=6,5 M
M1.V1 = M2 . V2
0,05 x 260 = 6,5 x V2
V2 = (0,05 x 260)/6,5
=2 ml


Tidak ada komentar:
Posting Komentar